
Ni Pfizer ni MODERNA han explicado por qué han decidido comunicar a la prensa estos resultados preliminares, sin que los escasos datos ofrecidos hayan sido evaluados por expertos anónimos independientes, sin conflictos de intereses (revisores de publicaciones biomédicas).
Los médicos y los científicos solemos adquirir nuevos conocimientos leyendo las publicaciones especializadas que otros muchos han filtrado y revisado. Se ha dicho que … “la falta de datos detallados molesta a muchos científicos. Lo normal es acompañar el anuncio con un estudio científico completo”, (Marcos López, presidente de la Sociedad Española de Inmunología). “Solo han dado un titular, ojalá se confirme, pero realmente no sabemos mucho”, dice también Isabel Sola, del Centro Nacional de Biotecnología (CNB).

Pero hay un ARGUMENTO CLÍNICO que, a mi juicio, tiene la máxima relevancia y que se resume en una palabra: CONFIANZA. Ofrecer una información COMPLETA basada en los datos del estudio es de especial importancia en un entorno de polarización, politización y desconfianza. Y la experiencia dice que la población general seguirá la conducta aconsejada por las personas en quienes tiene depositada su CONFIANZA.
¿Quién puede ofrecer el MEJOR CONSEJO, sobre un determinado tratamiento, que el MEDICO de CONFIANZA de cada sujeto? Y para ofrecer ese CONSEJO es necesario que el MEDICO conozca toda la información.
El 20 de noviembre 2020 mi buen amigo el Dr. Rafael Dal-Ré et al, han publicado en una revista médica de máximo prestigio unas consideraciones / consecuencias éticas y científicas en relación a la “aprobación y distribución de la vacuna COVID-19 con urgencia”. (https://doi.org/10.7326/M20-7357).

- ¿Habrá personas voluntarias que acepten “probar una nueva vacuna”, o seguir en los estudios actuales sabiendo que han recibido un placebo y que YA HAY una vacuna en el mercado muy eficaz?
- Obligará a cuestionar si se deben continuar los estudios de “vacuna-placebo”. Los promotores deberán informar a todos los participantes qué han recibido. Si muchos deciden retirarse del estudio para ser tratados con la vacuna-activa, NO dispondremos de datos comparativos en el medio y largo plazo. Esto es especialmente relevante para las vacunas con tecnología de RNAm, utilizadas por primera vez en el campo de la vacunación.
- La aprobación y distribución de la primera vacuna, condicionará el desarrollo clínico de las demás vacunas; es posible que muchos participantes en la rama de placebo decidan recibir la vacuna activa que confiere inmunidad, con lo cual los objetivos de esos estudios (“vacuna frente a placebo”) no podrán cumplirse y habrán de ser modificados.
29/11/2020 – Dr. Juan García Puig
Gracias por su pregunta. Voy a comenzar refiriendo los hechos que hemos conocido a través de los medios de comunicación generales –NO científicos– y después compartiré con Vd. mi opinión.
El lunes 9 de noviembre 2020, hace apenas 4 semanas, el periódico New York Times nos ofrecía este titular:
Los periodistas Katie Thomas, David Gelles y Carl Zimmer escribieron esta crónica:
La empresa farmacéutica Pfizer ha anunciado unos primeros resultados MUY POSITIVOS de un ensayo en fase III con una vacuna frente a la Covid-19 (miles de personas reciben una inyección intramuscular; la mitad reciben la vacuna activa y la mitad un placebo). Este estudio pretende saber cuántas personas contraen la enfermedad Covid-19 en el grupo que recibe la vacuna y en el grupo al que se le administra el placebo. Recordemos que las agencias, que tienen la responsabilidad de aprobar la vacuna para su administración a la población general, han establecido que la vacuna que aprueben DEBE tener una “eficacia de al menos el 50%”, similar a la eficacia de la vacuna de la gripe estacional.
Al parecer la vacuna que ha estudiado Pfizer en personas contra el coronavirus, y en un primer análisis de resultados efectuado por un comité de expertos independiente (Data Safety and Monitoring Board, DSMB), la protección que ofrece es superior al 90%, consolidando así el liderazgo en una frenética carrera mundial que se ha desarrollado a una velocidad récord.
Permítame ahora que responda a 5 preguntas para ofrecerle una idea general de lo que hemos sabido y de lo que nos queda por conocer: ¿En qué consiste esta vacuna? ¿Cómo se demuestra si es eficaz? ¿Quién la ha “inventado”? ¿Cuáles son los siguientes pasos? y, por último, ¿qué opinión tiene Vd.?
- ¿En qué consiste la vacuna desarrollada por Pfizer?
Todas las vacunas pretenden estimular al sistema inmunológico para que nos defienda frente a sustancias o microorganismos que causan enfermedad. Esto se puede lograr por múltiples vías, por ejemplo, estimulando al sistema inmunológico con partes del virus o con virus enteros pero muertos o atenuados. El sistema inmunológico reconoce esos componentes “extraños” y reacciona generando anticuerpos (inmunidad humoral) y excitando células de ataque y memoria (inmunidad celular) para defenderse frente a esas sustancias o microorganismos extraños y perjudiciales.
Esta vacuna desarrollada por Pfizer pertenece al grupo de vacunas llamadas “vacunas genéticas”. En la figura inferior se explica el funcionamiento de esta vacuna.
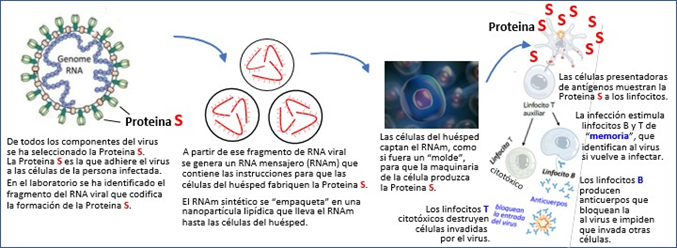
Hasta ahora NO se ha licenciado ninguna vacuna para las personas con material genético viable.
2.- ¿Por qué dicen que es eficaz (en más del 90%)?
Al parecer, y según la nota de prensa de Pfizer (https://www.pfizer.com/news/press-release/press- release-detail/pfizer-and-biontech-conclude-phase-3-study-covid-19-vaccine), este estudio de fase III se había planificado para incluir a 30.000 voluntarios. La mitad recibirían dos dosis de la vacuna y la mitad dos dosis de placebo. La segunda dosis de la vacuna o del placebo se administraría TRES semanas después de la primera dosis. La realidad es que en lugar de los 30.000 voluntarios previstos, se han incluido 43.661 sujetos, de los cuales 41.135 (94,2%) habían recibido la segunda dosis (30µg)a comienzos de noviembre 2020.

El miércoles 18 de noviembre 2020, Pfizer emitió un comunicado oficial, en el que resumía los datos principales de esta investigación, con más de 43.000 sujetos estudiados.
Seguridad: Al parecer solo hubo dos síntomas que superaron el 2%, de intensidad Grado 3 (interfiere seriamente con la vida del sujeto): “cansancio” –parecido a un síndrome gripal– (3.8%) y dolor de cabeza (2%).
Eficacia: Al parecer, excelente …. Con una enorme diferencia entre los casos de Covid-19 que aparecieron en el grupo de los “vacunados” (tan solo 8 casos) en comparación con los casos de Covid-19 en el grupo tratado con “placebo” (162 personas). Por tanto, la eficacia es de 162 x 100 / 170 = 95,3%.
El 41% de todos los participantes tenían entre 56 y 85 años de edad.
3. ¿Quién la ha inventado?
Según una crónica de David Gelles, publicada el pasado martes 10 de noviembre 2020, en el New York Times, el Dr. Ugur Sahin hizo una predicción audaz hace dos años en una conferencia celebrada en Berlín. En una sala llena de expertos en enfermedades infecciosas dijo que su empresa podría utilizar su tecnología del RNA mensajero (RNAm) para desarrollar rápidamente una vacuna en caso de una pandemia mundial.
En ese momento, el Dr. Sahin y su empresa, BioNTech, eran poco conocidos fuera del mundo de las nuevas empresas biotecnológicas europeas.
BioNTech, fundada por el Dr. Sahin y su mujer, la Dra. Özlem Türeci, se centró principalmente en tratamientos contra el cáncer.
El lunes 9 de noviembre 2020, BioNTech y Pfizer anunciaron que su vacuna para el coronavirus desarrollada por el Dr. Sahin y su equipo tuvo una eficacia superior al 90% para prevenir la enfermedad entre los voluntarios del ensayo que no estaban infectados previamente.
«Podría ser el comienzo del fin de la época Covid», dijo el Dr. Sahin al día siguiente martes.
BioNTech comenzó a trabajar en la vacuna en enero 2020, cuando el Dr. Sahin leyó un artículo en la revista médica The Lancet. El Dr. Sahin pensó que el coronavirus, que en ese momento se propagaba rápidamente en ciertos lugares de China, estallaría en una pandemia global. Los científicos de la empresa, con sede en Mainz, Alemania, cancelaron las vacaciones y se pusieron a trabajar en lo que llamaron Project Lightspeed.
«No hay muchas empresas en el planeta que tengan la capacidad y la competencia para hacerlo tan rápido como nosotros», dijo el Dr. Sahin en una entrevista el mes pasado. “Así que me pareció un deber hacerlo, porque me di cuenta de que podríamos estar entre los primeros en idear una vacuna”.
BioNTech identificó varias vacunas candidatas que podrían pasar a la fase de desarrollo clínico, con personas. El Dr. Sahin reconoció que su compañía necesitaría la ayuda de una farmacéutica para probarlas rápidamente, obtener la aprobación de los reguladores y llevar al mercado la vacuna mejor. BioNTech y Pfizer habían estado trabajando juntos en una vacuna contra la gripe desde 2018, y en marzo acordaron colaborar en una vacuna contra el coronavirus.
Desde entonces, el Dr. Sahin, que es turco, ha desarrollado una amistad con Albert Bourla, el director ejecutivo de Pfizer en Grecia. Ambos dijeron en entrevistas recientes que habían sintonizado por sus antecedentes compartidos de científicos e inmigrantes.
«Nos dimos cuenta de que él es de Grecia y que yo soy de Turquía», dijo el Dr. Sahin, sin mencionar el antagonismo ancestral de sus países de origen. «Fue muy personal desde el principio».
En la empresa BioNTech trabajan más de 1.800 personas.
Tiene oficinas en Berlín, en otras ciudades alemanas y en Cambridge, Massachusetts, EE.UU. El año pasado, la Fundación Bill y Melinda Gates invirtió 55 millones de dólares para financiar su trabajo para el tratamiento del VIH y de la tuberculosis. En 2019, el Dr. Sahin recibió el Premio Mustafa, un reconocimiento iraní bienal para premiar el trabajo de musulmanes en ciencia y tecnología.
BioNTech tiene un valor de mercado superior a los 21.000 millones de dólares. El matrimonio vive con su hija adolescente en un modesto apartamento cerca de su trabajo. No tienen coche y acuden a trabajar en bicicleta. «Ugur es una persona muy, muy singular», ha dicho Bourla, director ejecutivo de Pfizer, el mes pasado. “Solo le importa la ciencia. No le gusta en absoluto hablar de negocios. Es un científico y un hombre de principios. Confío en él al cien por cien».
En Alemania, donde la inmigración sigue siendo un tema conflictivo, el éxito de estos dos científicos de ascendencia turca ha sido motivo de celebración. “Con esta pareja, Alemania tiene un ejemplo brillante de integración exitosa”, ha publicado la revista de negocios semanal Focus.
4. ¿Cuáles son los siguientes pasos para que la vacuna llegue a toda la población?
Se me ocurren estos 10, al menos:
1.- Terminar los estudios en fase III (Pfizer, 43.998 sujetos) y analizar los datos.
2.- ¿Cuántos de los 164 “casos” previstos (estudios de Pfizer) han sido tratados con placebo y cuántos con la vacuna?
3.- Los “casos” … ¿se han diagnosticado en base a PCR, prueba de antígenos, anticuerpos?
4.- ¿Cuántos “casos” han sido leves / graves / hospitalizados / muertos?
5.- ¿Protege esta vacuna a los mayores de 60 -65 años?
6.- ¿Qué efectos secundarios se han registrado?
7.- En Europa NO se han vacunado menores de 18 años … que pueden infectarse y transmitir el virus. ¿Hay alguna actuación prevista?
8.- Es posible que algunos voluntarios no recibieran la segunda dosis, por diversos motivos. ¿Se sabe si una sola dosis es eficaz?
9.- Se ha mencionado que esta vacuna debe conservarse a -70 °C. ¿Qué logística van a desarrollar para que se pueda administrar a toda la población con garantías?
10.- En el seguimiento de los “casos” (hasta ahora 94) ¿se ha documentado que los que recibieron la vacuna y “enfermaron” han contagiado a menos personas que los que “enfermaron” con placebo? ¿Previene la vacuna de contagiar a otras personas?
NOTA IMPORTANTE: Al parecer Pfizer (18 noviembre 2020) ya ha analizado 170 casos de Covid-19 (162 recibieron placebo y 8 la vacuna) y ha comunicado una eficacia del 95%. La eficacia preventiva en mayores de 65 años ha sido del 94%. Pfizer va a solicitar la aprobación de la vacuna para su distribución mundial “en unos días” y está previsto que la agencia – institución de EE.UU. responsable de aprobar la vacuna (FDA, Federal Drug Administration) ofrezca un dictamen el 10 de diciembre 2020. Pfizer tendrá disponibles unos 50 millones de dosis a finales de 2020 y cerca de 1300 millones de dosis durante el año 2021.
Una semana después, el 16 de noviembre, conocimos que MODERNA, cuyo director científico es un español –Juan Andrés–, dijo que su vacuna, ahora en la fase III de los ensayos clínicos, con voluntarios, ha demostrado una eficacia del 94,5% (Ver artículo El País).
En este caso, MODERNA ha ofrecido alguna información adicional. Por ejemplo, que se han producido 95 casos de “infecciones sintomáticas”. De ellos, 90 sujetos habían recibido “placebo” y tan solo 5 la vacuna activa (eficacia, 90×100/95=94,7%). Al parecer hubo 11 voluntarios graves que requirieron hospitalización y los 11 habían recibido “placebo”. Ninguna persona ha fallecido.
También hemos sabido que de los 30.000 voluntarios, 7.000 (23%) tenían más de 65 años, lo que posibilitará obtener conclusiones sobre la seguridad y eficacia de la vacuna en los mayores. Nos han dicho que el 42% de los participantes tenía algún factor de riesgo adicional (hombre, sobrepeso, obesidad, EPOC, enfermedad cardiaca, renal o hepática crónica, etc.), y así podremos saber si la vacuna protege a estos enfermos de forma similar a los que NO tienen estos factores de riesgo.
5. ¿Qué opinión tiene Vd.? Comunicación de los RESULTADOS.
Mi opinión: Creo que las noticias que hemos conocido deben ser motivo de alegría. La CIENCIA puede llegar a dominar la pandemia causada por el virus SARS-CoV-2, y es comprensible la “urgencia” de comunicar resultados positivos en un contexto mundial de tanto dolor, incertidumbre, quebranto económico, y necesidad de “ver una luz”.
Pero los avances en CIENCIA no se dan a conocer, en primer lugar, por estos canales de difusión.

Dos días después del anuncio de Pfizer, se ha publicado en el diario EL PAÍS y en otros muchos medios, esta crónica y otras similares, que, en mi opinión, pueden sembrar DUDAS en la población general, a mi juicio, por una comunicación deficiente:
1.- “Más preguntas que respuestas” … En mi experiencia TODO avance científico “deja más preguntas que respuestas”. Y de hecho es casi una condición necesaria para alcanzar la categoría de AVANCE CIENTÍFICO. Dúdese del “descubrimiento” o “supuesto avance” que NO genera más preguntas que respuestas. El público general desconoce este hecho y NO creo que sea adecuado decir que “plantea más preguntas que respuestas” sin ofrecer más explicaciones, y
2.- Las comunicaciones científicas tienen unos cauces de difusión, muy bien establecidos: las publicaciones biomédicas de máximo prestigio. Todos los EDITORES de las principales revistas de medicina están recibiendo innumerables manuscritos sobre el virus y la enfermedad. ¿Acaso no se acelerará al máximo el proceso editorial para publicar los primeros resultados de un estudio sobre la eficacia y seguridad de una vacuna en fase III, que dice tener una eficacia superior al 90-95%, en un contexto global de una pandemia de estas dimensiones?

Ni Pfizer ni MODERNA han explicado por qué han decidido comunicar a la prensa estos resultados preliminares, sin que los escasos datos ofrecidos hayan sido evaluados por expertos anónimos independientes, sin conflictos de intereses (revisores de publicaciones biomédicas).
Los médicos y los científicos solemos adquirir nuevos conocimientos leyendo las publicaciones especializadas que otros muchos han filtrado y revisado. Se ha dicho que … “la falta de datos detallados molesta a muchos científicos. Lo normal es acompañar el anuncio con un estudio científico completo”, (Marcos López, presidente de la Sociedad Española de Inmunología). “Solo han dado un titular, ojalá se confirme, pero realmente no sabemos mucho”, dice también Isabel Sola, del Centro Nacional de Biotecnología (CNB).

Pero hay un ARGUMENTO CLÍNICO que, a mi juicio, tiene la máxima relevancia y que se resume en una palabra: CONFIANZA. Ofrecer una información COMPLETA basada en los datos del estudio es de especial importancia en un entorno de polarización, politización y desconfianza. Y la experiencia dice que la población general seguirá la conducta aconsejada por las personas en quienes tiene depositada su CONFIANZA.
¿Quién puede ofrecer el MEJOR CONSEJO, sobre un determinado tratamiento, que el MEDICO de CONFIANZA de cada sujeto? Y para ofrecer ese CONSEJO es necesario que el MEDICO conozca toda la información.
El 20 de noviembre 2020 mi buen amigo el Dr. Rafael Dal-Ré et al, han publicado en una revista médica de máximo prestigio unas consideraciones / consecuencias éticas y científicas en relación a la “aprobación y distribución de la vacuna COVID-19 con urgencia”. (https://doi.org/10.7326/M20-7357).

- ¿Habrá personas voluntarias que acepten “probar una nueva vacuna”, o seguir en los estudios actuales sabiendo que han recibido un placebo y que YA HAY una vacuna en el mercado muy eficaz?
- Obligará a cuestionar si se deben continuar los estudios de “vacuna-placebo”. Los promotores deberán informar a todos los participantes qué han recibido. Si muchos deciden retirarse del estudio para ser tratados con la vacuna-activa, NO dispondremos de datos comparativos en el medio y largo plazo. Esto es especialmente relevante para las vacunas con tecnología de RNAm, utilizadas por primera vez en el campo de la vacunación.
- La aprobación y distribución de la primera vacuna, condicionará el desarrollo clínico de las demás vacunas; es posible que muchos participantes en la rama de placebo decidan recibir la vacuna activa que confiere inmunidad, con lo cual los objetivos de esos estudios (“vacuna frente a placebo”) no podrán cumplirse y habrán de ser modificados.

